*仅供医学专业人士阅读参考
“高风险”HR阳性早期乳腺癌患者:如何定义?又该如何识别?
HR+/HER2-是最常见的乳腺癌(BC)亚型,尽管(新)辅助治疗联合或不联合化疗可显著降低HR+/HER2-早期BC(EBC)患者的复发和死亡风险,但是患者仍可能出现局部和/或全身复发。目前“高”和“低”风险的定义和个体水平的风险量化仍然具有挑战性。一项综述[1](i)指出目前有助于确定HR+ EBC复发风险的临床、病理学和基因组特征,(ii)探索基于液体活检的检测方法在细化风险评估中的潜在作用,以及(iii)讨论未来的观点和创新策略,以优化风险分层并选择患者进行升阶梯治疗,具有重要临床参考价值。现将重要内容梳理如下,以飨读者。
过去对于HR+/HER2-EBC复发的风险分层,主要依赖于临床病理学特征,包括年龄、绝经状态、肿瘤大小、淋巴结状态、组织学类型、肿瘤分级、HR表达水平(雌激素受体[ER]和孕激素受体[PR])和增殖标志物(Ki67/MIB-1)。所有这些变量都可以影响Luminal型EBC患者的预后,并被广泛应用于临床,以决定是否需要辅助化疗以外的内分泌治疗。
其中,淋巴结状态和肿瘤大小具有最强的预后价值,可以预测早期(0-5年)和晚期复发(>5年)。有趣的是,HR+/HER2-肿瘤似乎表现出与淋巴结受累相关的独特复发风险模式:在有4个以上淋巴结受累的患者中,复发风险逐渐降低,而在无腋窝受累或最多3个阳性淋巴结的患者中,复发风险随时间推移保持稳定。最近一项涉及6万多名患者的荟萃分析[2]显示,辅助ET治疗5年后的长期预后也与“T”和“N”状态密切相关。肿瘤和淋巴结状态显示了近似累加效应,20年时,远处复发风险从T1N0的13%逐渐增加至T2N2-3疾病的41%。
年轻时诊断BC是公认的BC复发和死亡的危险因素,在HR+/HER2-患者中更强。这种差异可能与年轻和老年女性肿瘤的内在生物学差异和治疗相关因素有关,包括年轻患者发生化疗诱导闭经的概率较低和ET依从性降低。
根据国际指南,应考虑年龄和绝经状态,以指导HR+/HER2-EBC的辅助治疗决策。尽管如此,这两个因素经常被互换用于定义早发性BC女性患者,它们的强相关性使得检查这些因素对BC风险的独立贡献具有挑战性。
肿瘤分级和Ki67染色是具有额外预后价值的病理学生物标志物,彼此之间密切相关,主要预测BC的早期复发。
根据诺丁汉评分系统的肿瘤分级是由三个形态学特征定义的复合变量:(i)管状形成;(ii)核多形性和(iii)有丝分裂计数。相反,Ki67是一种与细胞增殖相关的核抗原,在细胞周期的所有阶段(G0期除外)均有表达。根据2011年SanGallen的定义,这些生物标志物,连同HR水平和HER2表达,在临床实践中被广泛用于区分所谓的替代BC亚型。这些“替代”亚型被证明正确反映了基因组亚型在风险因素、自然史和治疗反应方面观察到的异质性,并被推荐为HR+/HER2-EBC辅助化疗决策过程的关键要素。Luminal A型BC(强ER和PR阳性、HER2阴性、分级和增殖标志物较低),传统上认为对化疗反应较差,是ET单药治疗的候选者。另一方面,Luminal B型(ER/PR较低,Ki-67明显较高,组织学肿瘤3级)通常被认为是“高风险”癌症,通常建议辅助化疗。
为了为日常肿瘤学实践提供易于获得的支持工具,将其中许多变量纳入多参数评分系统中,以生成每例患者BC复发和死亡概率的准确估计。其中诺丁汉预后指数(NPI)、PREDICT和Adjuvant Online!是开发的风险评估工具,用于帮助医疗保健提供者选择HR+/HER2-BC患者的辅助化疗。考虑到肿瘤大小、淋巴结受累和肿瘤分级计算NPI,并提供将患者分为三个不同预后组(PG)的评分(良好PG:NPI<3.4,15年OS 80%;中度PG:NPI 3.4-5.4,15年OS 42%;不良PG,NPI>5.4,15年OS 13%)。相反,PREDICT和Adjuvant Online!是基于计算机的经验证算法,当给予ET和/或化疗时,通过计算风险降低,根据基线肿瘤和患者相关变量估计个体死亡风险(表1)。尚未定义区分“低”和“高”临床风险的特定临界值,但每次将这些工具应用于个体研究时,研究者均选择了临界值。值得注意的是,PREDICT工具是更新的,并广泛用于临床实践和研究目的,而Adjuvant Online!已经过时,不再可用。
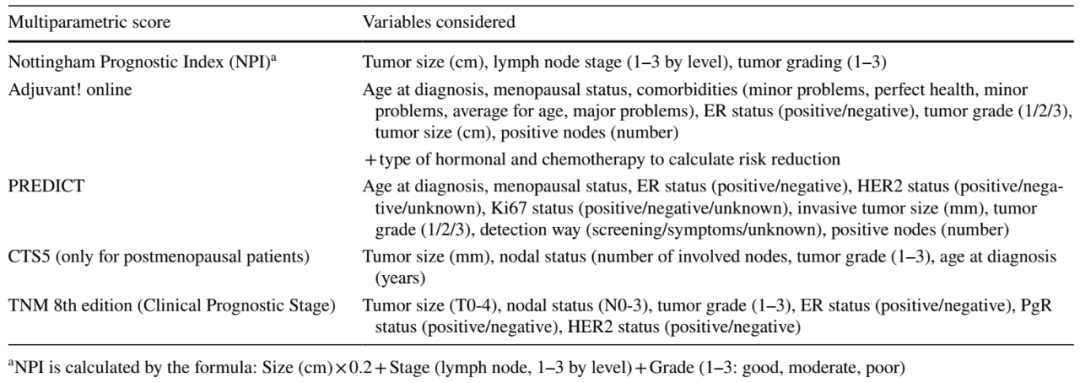
5年时的临床治疗评分(CTS5)是整合不同临床病理学数据的另一种预后工具。与上述评分相反,CTS5专门设计用于评估HR+EBC绝经后女性ET 5年后的远处复发风险,在讨论扩展辅助ET时,应将其视为支持工具。
值得注意的是,应综合考虑所有引用的临床和病理学变量,以定义个体患者的复发和死亡风险。即使对每例BC患者的该风险进行常规评估,仍无法获得基于临床病理学变量将哪些Luminal型BC患者归类为“高”或“低”风险的统一和明确定义。
2000年,Perou等人[3]首先提供了基于基因表达谱的BC分子分类,确定了6种转录组亚型(Luminal-A、Luminal-B、HER2富集、基底样、正常乳腺样和claudin-low)。随后开发了几种基因组标签,主要是改善HR+/HER2-EBC患者的预后和风险分层。
在针对每种检测试剂盒特定临界值和风险分层评分定义的小型培训数据集上进行的首次研究。OncotypeDX、Mammaprint和BCI预后评分为“纯基因组”(即通过数学算法中的基因表达谱计算),而ROR评分(Prosigna)和EPclin(Endopredict)整合了临床信息和基因组数据。同样,最近开发了RSClin工具,通过整合OncotypeDX21基因复发评分(RS)和临床病理学变量(年龄、肿瘤分级和肿瘤大小)的数据,个体化估计复发风险。
在证明其分析有效性后,然后对之前在大型、随机研究中收集的肿瘤样本进行这些检测,以研究其预测患者预后的临床有效性。所有工具在预后预测方面均显示出准确性,优于标准临床病理学特征。
值得注意的是,EPclin和RSClin工具均显示出比基因组评分(分别为EP和RS)或单独考虑的临床-病理学变量更高的预后性能。
总之,这些回顾性分析证明了这些检测的预后效力,即使基于这些结果无法对个体患者进行明确分类。事实上,应该注意的是,这些检测方法在基因选择和技术定量方面彼此不同。它们的创建并不相等,也不可互换,正在不同人群中开发和验证。
因此,对于临床病理学变量,明确的“高”和“低”基因组风险二分法仍然是无法实现的。很少有研究比较这些基因组检测的预测性能,但都表明它们之间的一致性并没有那么高。比较不同多参数评分的OPTIMA试验的最新分析显示,在人群水平的预后风险信息方面具有良好的一致性,但个体患者的风险分类和亚型信息不同,观察到高达30%的不一致病例[4]。由于这些原因,对于特定患者和肿瘤,应仅要求一种检测,选择时还应考虑验证的特定临床环境。
基于这些结果,设计了一些前瞻性研究来证明这些检测的预测价值。然而,应该注意的是,OncotypeDX是唯一在具有足够统计效力的研究(TAILORx和RxPONDER试验)中前瞻性验证预测能力的检测方法。对于所有其他检查,选择化疗患者的能力仅基于其预后能力。
通过检测微小残留病对风险进行分层:识别高风险患者的新工具
高通量测序方法的最新进展产生了支持BC突变机制的相关信息。同时,还实施了称为“液体活检”的无创诊断工具,用于检测和监测释放到外周血中的肿瘤组分。通过检测肿瘤源性组织,如循环肿瘤细胞(CTC)和循环肿瘤DNA(ctDNA),基于血液的液体活检可确定每种癌症的基因组特征,监测治疗反应,并评估潜在靶向分子改变的出现和耐药机制。有趣的是,在早期诊断并接受手术联合或不联合新(辅助)全身治疗的患者中,ctDNA的检测可能揭示微小残留病(MRD)的存在,即使没有任何临床和放射学疾病证据。MRD评估可以确定疾病复发风险较高的患者,并有助于对患者进行分层,以递增或递减辅助治疗。
在EBC患者中,完成根治性治疗后检测血浆ctDNA可准确预测转移复发。通过连续血浆采样的纵向突变追踪与单次术后采样相比能够改善复发预测,临床复发的中位前置时间为7.9-11.0个月[6],这与转移环境中的证据相似。此外,对I-SPY 2试验的二次分析表明[7],新辅助治疗后缺乏ctDNA清除是治疗反应差和复发风险高的强预测因子,而即使在未达到pCR的患者中,清除率也与生存率改善相关。同样,在EBC患者中检测到CTC是无病生存期和总生存期降低的独立预测因素。
在ctDNA血浆水平高的情况下,肿瘤细胞遗传改变的综合评估更容易。因此,与转移性疾病相比,早期癌症患者的ctDNA评估可能存在一些内在的局限性。通过应用更敏感的技术可以部分绕过这一问题。值得注意的是,ctDNA通常存在于未检测到CTCs的患者中,而其他研究在未检测到ctDNA的患者中发现了CTCs,这表明这两种生物标志物应该被视为不同的实体。在大约20%的EBC患者中确实可以检测到CTC。因此,ctDNA可能在疾病负担低且相对脱落的早期环境中更有用。最近的一项研究表明,这两种分析的结合可以提高预后能力和潜在的临床应用。
因此,MRD评估有可能重新定义EBC的辅助治疗。ctDNA阳性患者应被认为具有非常高的复发风险,是升级治疗以及研究新型疗法的临床试验的候选者。事实上,血浆中基因组改变的纵向采样可能为生物标志物驱动药物发生临床转移前的治疗干预创造机会。另一方面,ctDNA阴性的患者,在没有其他疾病复发的临床或基因组风险因素的情况下,应该被认为是低复发风险,甚至是不可忽略的。因此,该亚组可代表降级辅助治疗的目标人群。最后,ctDNA清除可作为辅助治疗疗效的替代标志物,并确定与辅助治疗原发性或继发性耐药相关的靶向基因组改变。
MRD在早期癌症中的应用仍然存在许多尚未回答的问题和挑战。首先,MRD评估指导辅助全身治疗的临床效用需要在前瞻性、干预性临床试验中得到证实。其次,几个技术问题,如残留疾病的适当临界值水平、使用的检测方法的选择和最佳采样时间,需要额外的验证。最后,考虑到早期癌症患者每毫升血浆中含有少于一个突变模板分子,有限的敏感性代表了一个相关问题。在此背景下,ctDNA检测与其他标志物的潜在组合,包括甲基化变化、循环mRNA、外泌体和蛋白质生物标志物,可以优化MRD在早期肿瘤中的应用。
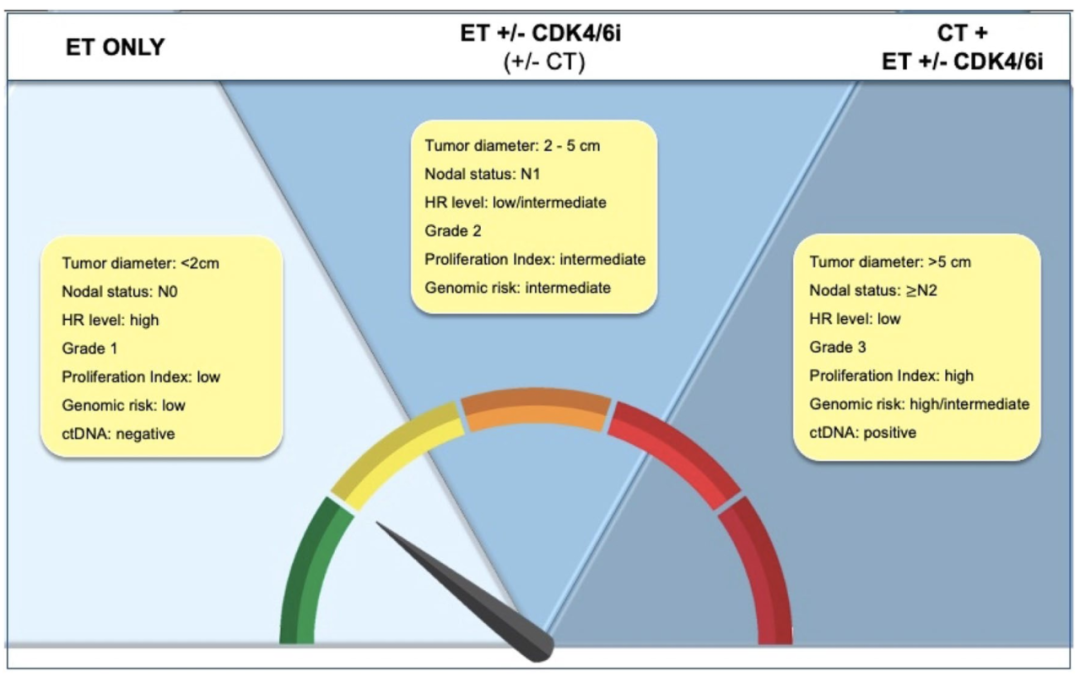
HR+/HER2-乳腺癌的风险分层依赖于传统的临床病理学特征(年龄、绝经状态、肿瘤大小、淋巴结状态、肿瘤分级、HR表达水平和增殖标志物),以及新开发的基因组评分,其可准确预测复发风险和生存期。包括临床病理学和基因组变量在内的多参数评分具有最高的预后效力。总之,“高”和“低”风险HR阳性EBC的最合适定义尚不清楚。因此,根据复发风险进行治疗升阶梯/降阶梯仍然具有挑战性。实施风险分层的新工具,如基于液体活检的检测,以及开发新型治疗策略十分必要。
参考文献:
[1]Morganti S, Marra A, Crimini E, et al. Refining risk stratification in HR-positive/HER2-negative early breast cancer: how to select patients for treatment escalation? Breast Cancer Res Treat. 2022 Apr;192(3):465-484.[2]Pan H, Gray R, Braybrooke J, et al. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med 377(19):1836–1846.[3]Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 406(6797):747–752.[4]Bartlett JM, Bayani J, Marshall A, et al. Comparing breast cancer multiparameter tests in the OPTIMA prelim trial: no test is more equal than the others.J Natl Cancer Inst.[5]Garcia-Murillas I, Schiavon G, Weigelt B, et al. Mutation tracking in circulating tumor DNA predicts relapse in early breast cancer. Sci Transl Med 7(302):302ra133.[6]Olsson E, Winter C, George A, et al. Serial monitoring of circulating tumor DNA in patients with primary breast cancer for detection of occult metastatic disease. EMBO Mol Med 7(8):1034–1047.[7]Magbanua MJM, Swigart LB, Wu HT,et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival. Ann Oncol 32(2):229–239.* 此文仅用于向医学人士提供科学信息,不代表本平台观点

BC新视界是聚焦于乳腺癌的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。